Aktualności
Mikrobiota – superorgan, który programuje nasze zdrowie
Człowiek nigdy nie jest sam, przez całe życie wiernie towarzyszą mu bakterie i inne mikroorganizmy zasiedlające ciało. Jednak szczególną rolę odgrywają te zamieszkujące przewód pokarmowy. Mają wpływ nie tylko na nasze zdrowie fizyczne, ale i psychiczne.
Jak radzić sobie przy antybiotykoterapii? Czym jest dysbioza jelitowa i jaki ma wpływ na depresję? Czy dziecko urodzone cesarskim cięciem ma szanse na zdrowe jelita? O tym i wielu innych ważnych kwestiach rozmawialiśmy z pediatrą i immunologiem, prof. dr hab. n. med. Bożeną Cukrowską. Pani Profesor jest kierownikiem Pracowni Immunologii Zakładu Patologii Instytutu „Pomnik – Centrum Zdrowia Dziecka”, naukowcem, autorką i współautorką bardzo wielu publikacji naukowych. Wywiad przeprowadzony przez Grażynę Konińską i Annę Marczewską ukazał się w 11 numerze naszego magazynu „Bez glutenu”.
Zacznijmy od definicji: mikroflora, mikrobiom, mikrobiota. Czy to jest to samo?
Wszystkie te terminy mówią o mikroorganizmach (głównie bakteriach, ale również wirusach i grzybach), które zasiedlają nasz organizm. Znajdują się na skórze, w układzie oddechowym, ale najwięcej bakterii zasiedla przewód pokarmowy, a szczególnie jelita. Dlatego najczęściej mówi się o mikrobiocie jelitowej. Mikroflora, mikrobiota, flora jelitowa – te terminy oznaczają to samo, czyli zespół mikroorganizmów. Obecnie preferujemy termin „mikrobiota”. Natomiast mikrobiom to jest zespół mikroorganizmów, które zostały zidentyfikowane za pomocą metod molekularnych. Czyli jest to genom bakterii zasiedlających na przykład nasze jelita, skórę czy inne fragmenty ciała.
Jak mikrobiota wpływa na nasze zdrowie?
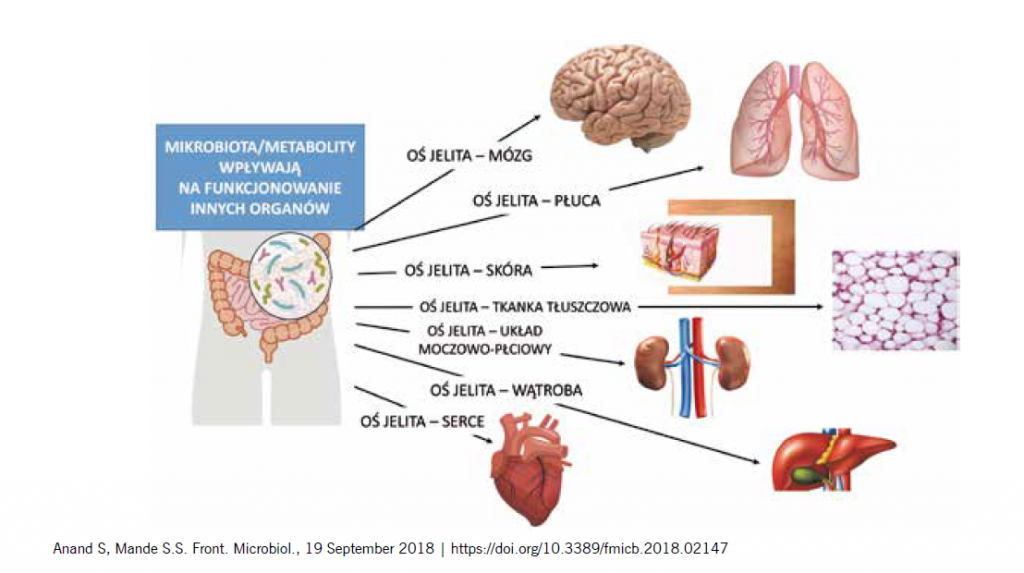
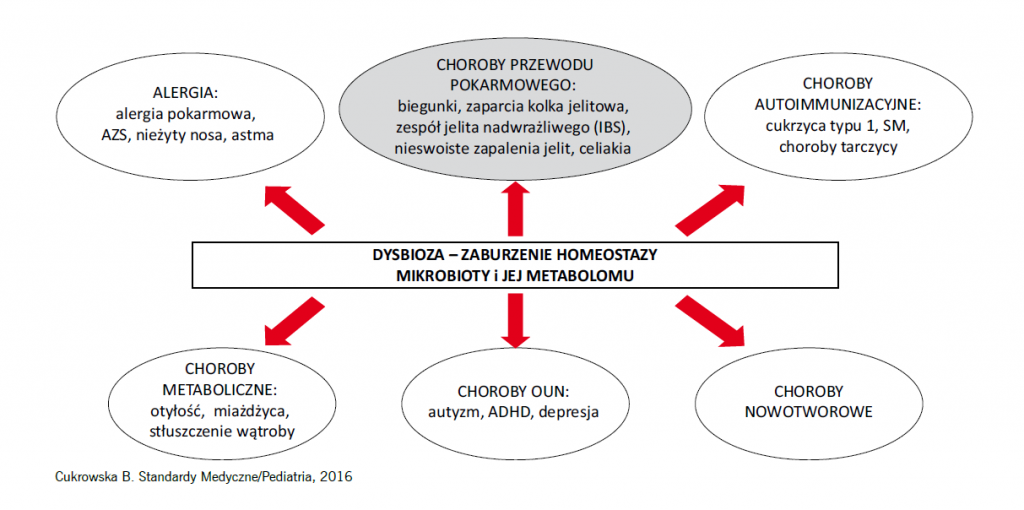
Mikrobiota ma olbrzymie znaczenie dla zdrowia człowieka. Twierdzi się, że zespół mikroorganizmów, które zasiedlają nasze ciało, a przede wszystkim jelita, tworzy tak zwany superorgan, który kontroluje funkcjonowanie różnych układów i narządów w naszym organizmie. A dysbioza, czyli zaburzenie składu mikrobioty, może indukować powstawanie wielu przewlekłych chorób, często zaliczanych do tzw. chorób cywilizacyjnych. W 2014 roku wprowadziłam wspólnie z panią profesor Elżbietą Klewicką pojęcie „programowania mikrobiologicznego”.
Co ono oznacza? Uważamy, że mikrobiota zasiedlająca organizm człowieka przez pierwsze tysiąc dni życia, włącznie z okresem prenatalnym, wpływa na to, na co będziemy chorować w przyszłości. W czasie tego tysiąca dni mikrobiota programuje nasze zdrowie na przyszłość.
Od wielu lat mówi się, że komórek mikrobioty, które zasiedlają przewód pokarmowy, jest dziesięciokrotnie więcej niż komórek naszego własnego ciała i nasz organizm żyje w stałej symbiozie z bakteriami, które go kolonizują. Jakie mamy z tego korzyści? Po pierwsze mikrobiota chroni organizm przed obcymi, często szkodliwymi dla człowieka mikrobami, buduje fizyczną barierę, sprawia, że nie ma wolnych miejsc do zasiedlenia patogenami. Jednocześnie mikrobiota aktywnie chroni nas przed mikroorganizmami patogennymi, produkując różnego rodzaju substancje przeciwbakteryjne, np. bakteriocyny, reuterynę. Po drugie, mikrobiota bezpośrednio wpływa na funkcjonowanie układu immunologicznego. Należy podkreślić, że jest to pierwszy bodziec, który stymuluje rozwój niedojrzałego układu immunologicznego dziecka tuż po narodzeniu.
Czy dla dziecka lepiej, by urodziło się w domu? Jego organizm byłby od razu zasiedlony przez dobre bakterie, natomiast w szpitalu są różne…
Lepiej, ale najczęściej nie jest to możliwe. Jednak nawet jeżeli dziecko rodzi się w szpitalu, ale jest to poród naturalny, a szpital ma wdrożone procedury pozwalające na bliski kontakt matka – noworodek, np. od razu po porodzie jest możliwy kontakt skóra mamy do skóry dziecka, przystawienie do piersi, to wtedy organizm takiego dziecka jest zasiedlony w pierwszym momencie przez bakterie, które znajdują się u matki. I do tego dążymy, to jest najważniejsze. Natomiast problem pojawia się, gdy dziecko rodzi się drogą cięcia cesarskiego, bo wtedy jego ciało jest zasiedlane przez bakterie szpitalne i personelu medycznego. A szpital to główne źródło organizmów patogennych, w tym bakterii odpornych na działanie antybiotyków. Na Zachodzie coraz więcej porodów odbywa się w warunkach domowych. W Polsce nie jest to takie popularne, ale wydaje się, że właśnie taki poród jest optymalny dla mikrobioty dziecka.
Jakie inne czynniki wpływają na mikrobiotę jelitową?
Bardzo ważnym czynnikiem kształtującym ją jest też dieta. Optymalny mikrobiom mają niemowlęta karmione piersią – minimum przez cztery miesiące, a najlepiej sześć lub dłużej. Badania pokazują, że jeżeli dziecko urodzone drogą cięcia cesarskiego jest karmione wyłącznie piersią przez minimum cztery miesiące po urodzeniu, to dysbioza spowodowana porodem może zostać zniwelowana, co ma wpływ na zdrowie w dalszym jego życiu. Spada ryzyko rozwoju chorób alergicznych w porównaniu z dziećmi, które były urodzone poprzez cięcie cesarskie, a nie były karmione naturalnie lub były dokarmiane. Badania pokazują, że im więcej czynników negatywnie wpływających na mikrobiotę, tym większe ryzyko rozwoju chorób. Stwierdzono na przykład, że siedmiokrotnie częściej chorują na astmę te dzieci, których mamy w trakcie ciąży albo laktacji brały antybiotyki, następnie te, które urodziły się drogą cięcia cesarskiego i są jedynakami.
Wiemy, że ważne jest całe środowisko, w którym się wychowuje dziecko. Zwierzęta domowe i warunki higieniczne, czyli taki „kontrolowany brud” – czy one też wspomagają mikrobiotę?
Pod koniec XX wieku epidemiolog Dawid Strachan stwierdził, że dzieci z rodzin wielodzietnych, które nie są „wychuchanymi” jedynakami, które nie wychowują się w sterylnych warunkach, rzadziej chorują na alergię. Jego teoria, zwana również higieniczną teorią Strachana, zakładała, że nadmierna higiena nie trenuje naszego układu immunologicznego i nie pozwala na rozwój tolerancji immunologicznej na alergeny.
Ta teoria uległa pewnej modyfikacji, gdyż obecnie mówimy o mikrobiotycznej teorii rozwoju chorób przewlekłych, w tym alergii. Zakłada ona, że nadmierny reżim higieniczny i brak kontaktu z innymi dziećmi nie pozwalają na rozwój zróżnicowanej mikrobioty – a bioróżnorodność mikrobioty jest istotna. Gwałtowny wzrost występowania alergii, chorób autoimmunizacyjnych (w tym celiakii), przewlekłych chorób zapalnych, który obserwuje się od 20–30 lat, jest spowodowany zachodnim trybem życia, który wiąże się z wysokim reżimem higienicznym, „przetworzoną” dietą, zmniejszeniem liczebności rodzin, zwiększeniem liczby cięć cesarskich.
Przekłada się to na mniej zróżnicowany mikrobiom i na zaburzoną funkcjonalność mikrobioty, co skutkuje rozwojem wielu chorób. Tak więc środowisko jest bardzo ważne. Są badania, które pokazują, że kontakt mam w czasie ciąży ze zwierzętami hodowlanymi, co najczęściej dotyczy kobiet, które pracują na wsi, w rolnictwie, chroni dzieci przed rozwojem alergii. Nie wiemy, czy chodzi o kontakt ze zwierzętami, czy ogólnie kontakt z naturą. W przypadku zwierząt domowych badania pokazują, że np. obecność psa w domu, a najlepiej kilku psów, może chronić przed rozwojem alergii. Natomiast jeżeli chodzi o koty, nie jest to tak jednoznaczne. Wydaje się, że koty raczej pobudzają proces alergiczny.
Proszę zatem zobaczyć, jak wiele czynników wpływa na naszą mikrobiotę: rodzaj porodu, sposób karmienia, dieta dziecka, kontakt ze środowiskiem, obecność innych dzieci, zwierzęta, przebyte infekcje, antybiotyki.
Wiemy, że na nasze bakterie jelitowe fatalnie wpływa antybiotykoterapia. Jak uratować swoją mikrobiotę, przyjmując te leki?
Stosowanie antybiotyków ma ogromny wpływ na mikrobiotę jelitową. Powoduje dysbiozę jelitową, czego bezpośrednią konsekwencją są biegunki poantybiotykowe. Co piąte dziecko, a nawet co trzeci dorosły po stosowaniu antybiotyków ma biegunkę poantybiotykową. Może ona występować w trakcie antybiotykoterapii i tuż po niej, ale czasami pojawia się nawet po miesiącu od jej zakończenia. I wtedy rzadko kojarzy się nam z przyjmowaniem antybiotyków.
Antybiotykoterapia wiąże się również z zasiedlaniem jelit przez szczepy oporne na antybiotyk. Dodatkowo obserwujemy efekty, które są jej długotrwałym następstwem. Badania epidemiologiczne pokazują, że im więcej przyjmujemy antybiotyków, zwłaszcza w czasie wspomnianego programowania mikrobiologicznego, czyli w pierwszym tysiącu dni życia, tym większą mamy potem predyspozycję do różnych chorób przewlekłych – alergii, ale też chorób zapalnych, na przykład celiakii.
A w których jeszcze schorzeniach występuje dysbioza jelitowa?
Występuje w większości chorób przewlekłych: alergiach, chorobach o podłożu autozapalnym (np. chorobie Crohna, wrzodziejącym zapaleniu jelita grubego) i autoimmunizacyjnym, np. cukrzycy typu 1. Coraz częściej podkreśla się znaczenie dysbiozy w zespole metabolicznym, otyłości, chorobach wątroby, np. niealkoholowym stłuszczeniu wątroby.
Mikrobiota ma wpływ nie tylko na układ immunologiczny, ale również na funkcjonowanie układu endokrynnego i nerwowego. Na przykład okazało się, że głównym miejscem wytwarzania serotoniny jest jelito. Uważa się, że zaburzenie funkcjonowania osi mikrobiota – jelita – mózg może prowadzić do zaburzeń zachowania, nadpobudliwości, zaburzeń ze spektrum autyzmu, ciągłego zmęczenia, stanów depresyjnych, a nawet schizofrenii.
Czy to znaczy, że modyfikując naszą mikrobiotę, możemy leczyć różne schorzenia?
Wydaje się, że tak, i dlatego może zacznijmy od tego, w jaki sposób możemy mikrobiotę modyfikować. Jedną z metod jest podawanie różnego rodzaju żywych bakterii korzystnie wpływających na zdrowie człowieka, zwanych probiotykami, oraz substancji, które są wykorzystywane przez probiotyki, czyli prebiotyków. Produkty, w których zawarte są probiotyk i prebiotyk, nazywamy synbiotykami. Probiotyki/synbiotyki mogą modulować skład naszego mikrobiomu, chronić go przed zasiedlaniem patogenami i bezpośrednio stymulować funkcjonowanie układu immunologicznego.
Czyli powinniśmy zażywać probiotyki już w trakcie antybiotykoterapii, nie wystarczy po jej zakończeniu?
Obecne rekomendacje ESPGHAN (European Society for Paediatric Gastroenterology, Hepatology and Nutrition) dotyczące dzieci zalecają stosowanie probiotyków w trakcie antybiotykoterapii.
Jak długo powinniśmy je przyjmować? Czy po dłuższej kuracji antybiotykami wystarczą dwa – trzy tygodnie? Parę miesięcy? Całe życie?
Na to pytanie Paniom nie odpowiem. Badania naukowe potwierdziły, że podanie probiotyków w trakcie antybiotykoterapii znacząco zmniejsza występowanie biegunki poantybiotykowej. Praktycznie nie ma jednak badań sprawdzających efekt przedłużonej probiotykoterapii po leczeniu antybiotykami. Są natomiast badania, które mają na celu sprawdzenie, czy profilaktyczne podawanie probiotyków zmniejsza ryzyko rozwoju pewnych chorób. Chodzi o sytuacje, gdy nie ma jeszcze choroby, a już podajemy probiotyki, najczęściej w grupach ryzyka, np. rozwoju alergii. Podajemy wtedy probiotyki długo, nawet przez sześć miesięcy.
I czy to działa? Czy te zdrowe bakterie zasiedlają nasze jelito?
Dziękuję za to pytanie. Wiemy, że probiotyki w większości trwale nie zasiedlają przewodu pokarmowego. Wobec tego po co je podajemy profilaktycznie? Bo mogą wpływać na kształtowanie mikrobiomu. Najwięcej badań dotyczy alergii. Badania pokazują, że podawanie probiotyku matce w ostatnim trymestrze ciąży, a następnie dziecku (niemowlęciu) bez objawów alergii przez sześć miesięcy po narodzeniu chroni dziecko przed rozwojem atopowego zapalenia skóry.
Prawie dwukrotnie obniża częstotliwość jego występowania w wieku dwóch lat u takich dzieci. Pierwsze badania wskazujące na profilaktyczne efekty probiotyków zostały opublikowane w 2001 roku. Potem podobnych analiz było coraz więcej i okazało się, że te same probiotyki, które chroniły dzieci w krajach skandynawskich, nie działały na przykład u Niemców. Zatem efekt działania danego probiotyku zależy nie tylko od konkretnego szczepu, ale także od populacji. To co działa na Skandynawów, nie działa w populacji niemieckiej. Może też być tak, że dany probiotyk działa u dzieci, które urodziły się drogą cięcia cesarskiego, a u dzieci urodzonych drogą naturalną – nie, ponieważ mają one inny mikrobiom. Dlatego też do tej pory nie ma jednoznacznych wytycznych dotyczących profilaktycznego stosowania probiotyków.
Może bezpieczniej jest więc nie podawać tego samego probiotyku przez dwa tygodnie, tylko zmieniać? Tydzień jeden, tydzień drugi?
Teoretycznie wydaje się, że nie jest to zły pomysł, ale nie ma żadnych badań, które by to potwierdzały. Po prostu nikt ich nie robi. Są za to badania, które okazują, że na przykład wieloszczepowe probiotyki, czyli mniej więcej to, o czym Pani mówi, dają lepsze efekty w leczeniu dysbiozy w niektórych schorzeniach, na przykład w zespole jelita drażliwego, niż jednoszczepowe. Nie dotyczy to biegunek antybiotykowych. W ich przypadku dane z badań naukowych wskazują na szczególną skuteczność bakterii z gatunku Lactobacillus rhamnosus (szczepu L. rhamnosus GG) i drożdży Sacharomyces boulardii. Dysbiozę poantybiotykową w postaci biegunki powodują głównie antybiotyki szerokowachlarzowe, czyli działające na liczne grupy bakterii. Na przykład penicylina mniej szkodliwie wpływa na nasz mikrobiom niż amoksycylina z kwasem klawulanowym, która ma szersze spektrum działania bakteriobójczego. Tylko jak dopasować probiotyk do danego antybiotyku? To już jest trudne zadanie.

Wróćmy jeszcze do kwestii małego dziecka. Tworzy się u niego mikrobiota, ale dostaje antybiotyki, zakładamy, że razem z probiotykami. Czy jego organizm jest w stanie przywrócić tę poprzednią mikrobiotę, czy jest ona już trwale zmieniona?
To ciekawe pytanie. Nie umiemy w tej chwili na nie jednoznacznie odpowiedzieć. Możliwe, że może nastąpić powrót do tej pierwotnej mikrobioty, ale jest to bardzo długotrwały proces. Kilka, kilkanaście tygodni, a nawet miesięcy. Możliwe jest też, że po antybiotykoterapii mikrobiota już nigdy nie wraca do pierwotnego stanu. Myślę, że jest to indywidualny proces i zależy od wielu czynników.
Jakie probiotyki wybrać? Czy któreś są lepsze, a inne gorsze? Czy może najbezpieczniejszy jest kefir?
No właśnie, mówimy o probiotykach, ale nie mówimy, w jakiej postaci mogą być podawane. Probiotyk może być spożywany w postaci tak zwanej żywności funkcjonalnej, zawierającej żywe bakterie powodujące fermentację. Czyli to są kefiry, zsiadłe mleko, jogurty, rozmaite kiszonki. Jest wiele badań, które mówią, że spożywanie bakterii probiotycznych znajdujących się właśnie w żywności funkcjonalnej daje dobre efekty nawet przy antybiotykoterapii. Probiotyki mogą być też podawane w postaci gotowych preparatów. Najczęściej są to suplementy diety, czyli produkty, których skład (rodzaje szczepów i ich liczba) jest dokładnie znany. A jaki konkretny probiotyk wybrać? Wiemy, że działanie probiotyków jest szczepozależne, czyli musimy przyjmować te, których działanie jest udowodnione w badaniach klinicznych.
W tej chwili ESPGHAN, tak jak już wspomniałam, w celu profilaktyki biegunek poantybiotykowych rekomenduje dwa szczepy posiadające przynajmniej dwa badania kliniczne potwierdzające korzystne efekty: Lactobacillus rhamnosus GG i drożdże Sacharomyces boulardii. Drugie zalecenie dotyczy profilaktyki infekcji – również w tym przypadku na pierwszym miejscu jest szczep Lactobacillus rhamnosus GG.
Czy probiotyki muszą zawierać żywe bakterie, czy mogą też mieć w składzie martwe?
Sama definicja mówi, że probiotyk to są żywe mikroorganizmy, które podane w odpowiedniej dawce mają korzystny wpływ na zdrowie człowieka. Niestety raport NIK-u z 2017 roku pokazał, że w około 90% probiotyków sprzedawanych na polskim rynku skład produktu nie zgadza się z opisem na etykiecie. Albo tych bakterii jest o wiele mniej niż powinno, albo są inne niż w opisie, albo w ogóle suplement nie zawiera żywych bakterii. Nie znaczy to, że martwe bakterie nie mogą wpływać na organizm człowieka, bo są badania, które pokazują takie efekty, ale to jest temat na odrębny artykuł. Probiotyki muszą być żywe. A niestety wysoka temperatura i wilgotność niekorzystnie wpływają na żywotność bakterii probiotycznych, szczególnie gdy nie są one chronione za pomocą np. mikrokapsulacji lub innych innowacyjnych technologii. „Niechronione” probiotyki powinno się przechowywać w lodówce.
Czy może być tak, że podawanie probiotyków nie pomaga?
Niestety tak. Mikrobiotę łatwo jest zniszczyć, a bardzo trudno odbudować.
A czy są inne sposoby?
Innym sposobem na jej odbudowę jest przeszczep kału, czyli przeszczep całego mikrobiomu jelitowego od zdrowej osoby. W tej chwili jest jedno udokumentowane wskazanie do takiego przeszczepu: nawracające zakażenie Clostridium difficile. Udowodniono skuteczność tego typu leczenia w 70–90%.
Czyli na przykład osoby z celiakią oporną na leczenie dietą, które liczyły na to, że po przeszczepie kału ich zdrowie może się poprawić, są w błędzie?
Jest jeden ciekawy przypadek pacjentki, która miała od wielu lat celiakię oporną na leczenie dietą, potwierdzoną badaniami histopatologicznymi. Była leczona immunosupresyjnie. Jednocześnie miała infekcję Clostridium difficile, nieskutecznie leczoną antybiotykiem. Dlatego została zakwalifikowana do przeszczepu kału. Leczenie podziałało, pacjentka nie miała już nawrotów biegunki związanej z Clostridium difficile. Dodatkowo zrobiono jej biopsję jelita cienkiego. Poprzednio utrzymywały się u niej w jelicie zmiany opisywane jako Marsh 3, a po przeszczepie kału okazało się, że śluzówka jelita cienkiego się wygoiła i nie ma żadnych zmian.
Czyli możemy liczyć na to, że w przyszłości celiakię będzie się leczyło przeszczepem kału?
To jest na razie jeden opisany przypadek. Ale jeśli weźmiemy pod uwagę, że większość chorób autoimmunizacyjnych (do których należy celiakia) jest związana z trwałą dysbiozą, możliwe, że to wskazanie do przeszczepu kału będzie znacznie szersze niż tylko nawracająca infekcja Clostridium dificile. Badania pokazują, że skład mikrobiomu u osoby z celiakią jest inny niż u osoby zdrowej. Po wprowadzeniu diety bezglutenowej oczywiście znów się zmienia, ale nie osiąga stanu takiego, jaki jest u osób zdrowych.
Czyli można by się pokusić o stwierdzenie, że samo wprowadzenie diety bezglutenowej u osoby świeżo zdiagnozowanej to za mało. Należałoby jeszcze podziałać na mikrobiom, odbudować go.
Bardzo możliwe. I dlatego być może w przyszłości będzie można leczyć celiakię przeszczepem kału. Dieta bezglutenowa nie niweluje dysbiozy. Dlaczego? Tego nie wiemy. Może jest to spowodowane predyspozycją genetyczną, która odgrywa znaczną rolę w tej chorobie. U niektórych pacjentów pomimo stosowania diety bezglutenowej ciągle utrzymują się objawy. Zmniejszają się, ale nie ustępują. Dotyczy to zwłaszcza pacjentów, u których celiakia została rozpoznana w późniejszym wieku.
Wydaje się, że dysbioza jest już tak utrwalona, że sama dieta bezglutenowa nie jest w stanie poprawić stanu jelit. Możliwe, że u tych pacjentów trzeba będzie modulować jeszcze mikrobiom, np. poprzez odpowiednio dobrany probiotyk.
A czy obecny tryb życia, czyli mało ruchu, mało słońca, dużo czasu spędzanego przed komputerem, wpływa na mikrobiom?
Tak, styl życia ma ogromny wpływ. Może nie tak silny jak dieta, ale ma. Regularne ćwiczenia fizyczne, codziennie przez 15 minut lub pół godziny raz na dwa dni, mają korzystny wpływ na mikrobiom. Ale z drugiej strony nadmierny wysiłek fizyczny, np. u wyczynowych sportowców, ma działanie negatywne.
Czy są jakieś poziomy dysbiozy? Lżejsza, cięższa?
Obecnie nie mamy wzorca optymalnej mikrobioty, na który moglibyśmy się powołać, dlatego trudno jest mówić o stopniach dysbiozy. W Polsce są już podejmowane próby zbadania, jak powinien wyglądać mikrobiom przeciętnego Polaka – zdrowego, niechorującego na żadne schorzenia przewlekłe, który sam siebie określa jako osobę zdrową. Jednak chciałabym podkreślić, że mikrobiom każdego człowieka jest bardzo indywidualny, często porównywalny do odcisku palca, unikatowy i przypisany do jednostki.
W „Science” pojawił się kilka lat temu artykuł, który analizował czynniki wpływające na mikrobiotę dwóch populacji: holenderskiej i belgijskiej. Osoby, które były w tych krajach, wiedzą, że tam praktycznie nie ma granicy. Okazało się, że ludzie mieszkający w każdym z nich mają zupełnie inną mikrobiotę, czyli nawet między tak bliskimi populacjami są duże różnice. Na mikrobiotę każdego z nas ma wpływ bardzo wiele czynników: geny, wiek, choroby, dieta, leki, płeć, stres.
I jeszcze pytanie, czy to prawda, że jelita zarządzają naszym mózgiem. Chodzi np. o leczenie depresji.
Już o tym wspomniałam wcześniej. Zakłada się, że istnieje oś: mikrobiom – bariera jelitowa – mózg. Można powiedzieć w skrócie, że jelita zarządzają naszym mózgiem, ale mówiąc „jelita”, myślimy „mikrobiota”, czyli drobnoustroje żyjące w jelicie. Mikrobiota aktywuje układ endokrynny, nerwy, które znajdują się w przewodzie pokarmowym. Poprzez nerw błędny i układ współczulny wpływa na ośrodkowy układ nerwowy. Bakterie stymulują także wydalanie różnych mediatorów, metabolitów, które nazywamy w tej chwili postbiotykami. Są to niskocząsteczkowe substancje produkowane przez bakterie w jelitach, które przenikają przez barierę nabłonkową jelita, dostają się do krwi, następnie przechodzą przez barierę krew – mózg i aktywują receptory w ośrodkowym układzie nerwowym. Oprócz tego jelita są głównym miejscem wytwarzania serotoniny, czyli tzw. hormonu szczęścia. Serotonina należy do grupy amin biogennych i jest ważnym neuroprzekaźnikiem w ośrodkowym układzie nerwowym.
Czyli jak najbardziej można powiedzieć, że mikrobiota, która znajduje się w naszych jelitach, ma wpływ poprzez oś jelitowo-mózgową na funkcjonowanie mózgu.
Jest coraz więcej prac, które pokazują, że dysbiozę jelitową mają chorzy na depresję, schizofrenię, osoby z zaburzeniami ze spektrum autyzmu. Obecnie są prowadzone bardzo duże projekty badawcze, oceniające wpływ przeszczepu mikrobiomu u pacjentów ze spektrum autyzmu. I pierwsze wyniki są bardzo obiecujące.
A odwracając sytuację: czy mózg może mieć wpływ na mikrobiotę?
Zrobiono ciekawe badania studentów w trakcie sesji egzaminacyjnej, kiedy byli oni poddani silnej presji, stresowi. Okazało się, że w trakcie sesji skład ich mikrobioty był inny niż poza sesją. Na razie są tylko hipotezy na ten temat, ale zakładamy, że cały układ mikrobiota – mózg działa na zasadzie sprzężenia zwrotnego.
Bardzo dziękujemy Pani Profesor za rozmowę.




